Gran parte de la rutina del científico consiste en diseñar y realizar experimentos.
La combinación de técnicas de laboratorio responderá a la mayoría de las preguntas propuestas por los científicos, y el flujo de trabajo para sugerir nuevos métodos depende de la formación y experiencia del científico.
Para los biólogos, las imágenes celulares pueden decir mucho sobre lo que ocurre en los procesos y mecanismos que estudian.
Microscopía óptica es una técnica muy extendida en las ciencias biológicas.
El uso de tintes, anticuerpos y sondas fluorescentes permite a los científicos ver en las células del microscopio imágenes de lo que de otro modo sería demasiado pequeño para ser visto e incluso comprendido.
Microscopios de fluorescencia y el uso de fluorocromos fue posible en 19301Hoy en día es posible utilizar muchas combinaciones de fluorocromos para teñir proteínas, orgánulos y estructuras de células y tejidos.
Fluorocromos (o fluoróforos) son moléculas que, al ser excitadas con una longitud de onda de luz específica, emiten luz de una longitud de onda definida que será captada por las lentes de un microscopio y transformada en una imagen real.
La combinación de fluorescencia, lentes y cámaras nos permite tomar una imagen de los procesos en el interior de las células en muchos puntos de vista y aspectos diferentes.
Por ejemplo, con el microscopio tenemos una visión más amplia de un corte de cerebro de ratón en un objetivo 2,5x o 4x, y pequeños detalles del citoesqueleto de actina sondeado en la misma muestra utilizando un objetivo 63x.
Para realizar estos ensayos, podemos utilizar anticuerpos o colorantes contra proteínas específicas presentes en la célula o el tejido, y el anticuerpo suele ir acompañado de un fluoróforo.
El desplazamiento de Stokes explica este fenómeno: los fluoróforos pierden energía vibracional en forma de luz emitida cuando pasan de un estado excitado al estado básico. Los microscopios de fluorescencia proporcionan la luz para excitar el fluoróforo y reciben su luz emitida. La luz emitida puede ser captada por una lente, procesada en una cámara CCD y transformada en una imagen digital.
Pero hablemos de la adquisición de imágenes de células más adelante. Ahora, debemos presentarle ejemplos y consejos para los pasos principales antes de adquirir su imagen.
¿Cómo elegimos y combinamos distintos tipos de tintes y anticuerpos para ver y comprender las relaciones entre orgánulos y proteínas dentro de las células o los tejidos?
En primer lugar, los científicos deben determinar qué anticuerpos y colorantes utilizar en función de su investigación.
Por ejemplo, en este artículoMendonça intentaba evaluar en ratas los efectos y posibles riesgos de las nanopartículas lipídicas sólidas catiónicas (NLSc). Cada año se desarrollan y estudian muchas nanopartículas con el objetivo de mejorar la administración de fármacos o genes para tratar muchas enfermedades. Una de las preguntas interesantes de este estudio era si las nanopartículas eran capaces de llegar al cerebro atravesando la barrera hematoencefálica. Esta barrera protege nuestro cerebro de toxinas o patógenos circulantes y, por lo general, no es deseable que las moléculas crucen la barrera. Pero en este caso concreto, Mendonça El objetivo era que las nanopartículas atravesaran la barrera y llegaran al cerebro, para administrar fármacos o genes en una futura aplicación.
Dispuestos a ver si las nanopartículas estaban presentes en el parénquima cerebral, los autores utilizaron un marcador de células endoteliales para los vasos llamado RECA-1 (representado en rojo), mientras que los núcleos celulares se tiñeron con un colorante llamado DAPI (4′,6-diamidino-2-fenilindol) que es azul. También podemos observar pequeños puntos verdes para las nanopartículas fuera de los vasos, lo que significa que llegaron al parénquima cerebral.
Consulte a continuación la infografía con una imagen de representación.
Entendamos lo que hace el anticuerpo para RECA-1 (rojo).
Estos anticuerpos están diseñados para servir como sondas específicas y se dirigen a un antígeno concreto (en nuestro caso, la proteína RECA-1).
Pueden marcarse con un fluoróforo o reconocerse posteriormente mediante un anticuerpo secundario unido a un fluoróforo.
Por lo tanto, después de excitar la muestra con una fuente de luz, la proteína específica que busca se reconocerá en su muestra por la emisión de luz en una longitud de onda específica.
En el caso del DAPI, este colorante es un contratinción de núcleos y nucleosomas, y emite fluorescencia azul cuando se une a regiones AT del ADN.
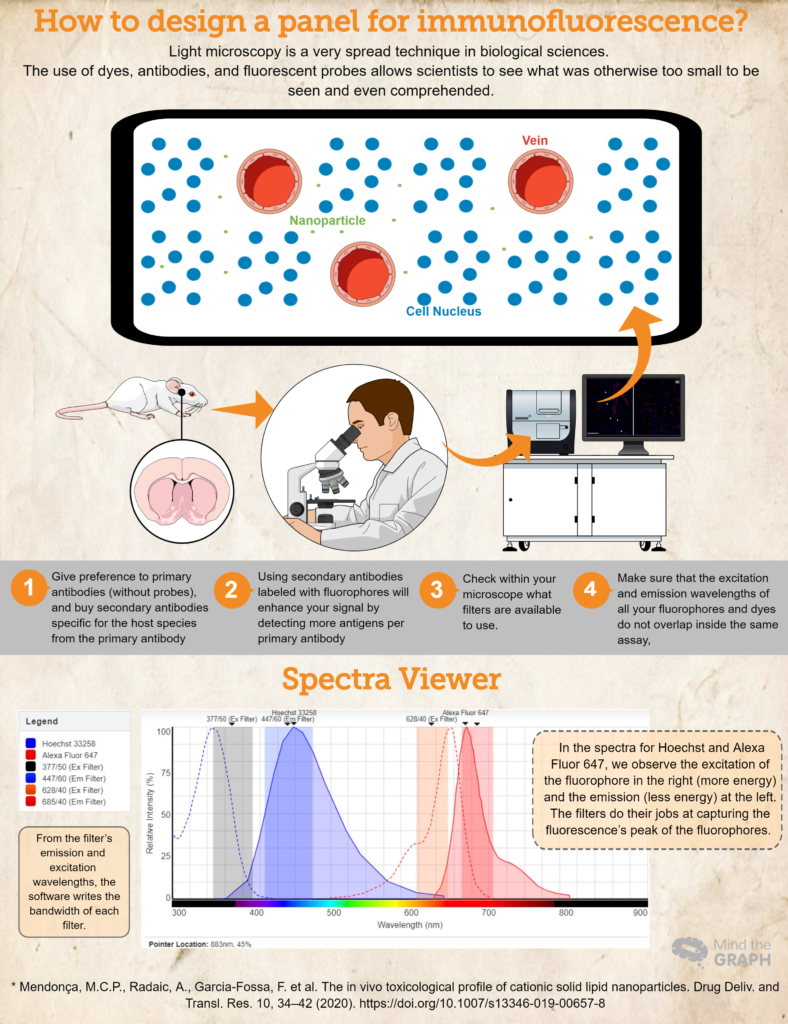
¿Cómo diseñar un panel para inmunofluorescencia?
Empieza con estos pasos:
- Compre (¡o pida prestados! ¡La ciencia debe ser muy colaborativa!) los anticuerpos y colorantes esenciales para su investigación. Dé preferencia a los anticuerpos primarios (sin sondas) y compre anticuerpos secundarios específicos para la especie huésped del anticuerpo primario. Por ejemplo, si utiliza un anticuerpo primario producido en conejos, utilice un anticuerpo secundario anti-conejo. Esto garantizará la especificidad.
- El uso de anticuerpos secundarios marcados con fluoróforos mejorará su señal al detectar más antígenos por anticuerpo primario. Además, esta es una forma más dinámica de elaborar diferentes ensayos, ya que permite al investigador modificar los colores del panel en función de sus necesidades.
- Otro paso importante es comprobar en el microscopio qué filtros se pueden utilizar. Debe asegurarse de que las longitudes de onda de excitación y emisión de su fluoróforo se encuentran dentro de los filtros de excitación y emisión; de lo contrario, no podrá capturar la luz de emisión de sus sondas. Puede utilizar Visor de espectros de fluorescencia para comprobar la compatibilidad.
- Para asegurarse de que las longitudes de onda de excitación y emisión de todos sus fluoróforos y colorantes no se solapan dentro del mismo ensayo, Visor de espectros de fluorescencia es una gran elección. Cubren casi todos los fluoróforos disponibles.
Finalmente, revise un ejemplo para un experimento hipotético donde tenemos Hoechst 33258 para los ácidos nucleicos, y un anticuerpo primario contra RECA-1 marcado con un anticuerpo secundario Alexa Fluor 647.
Lo ideal sería utilizar un microscopio disponible con un cubo DAPI (excitación 377/50 y emisión 447/60), y un cubo CY5 (excitación 628/40 y emisión 685/40). Toda esta información la insertamos en Visor de espectros de fluorescencia y obtuve los espectros de ambos colorantes, así como los anchos de banda de ambos cubos (echa un vistazo al espectro en la infografía de arriba).
Este ensayo hipotético es un buen ejemplo en el que los espectros de los fluoróforos se encuentran dentro de los filtros de excitación y emisión, lo que permite al investigador captar sus muestras de la mejor manera posible.
Ahora, ¡es hora de ir al laboratorio y ponerlo todo en práctica!
Espero que estos consejos te ayuden en tu próximo experimento de laboratorio. Mucha suerte.
Referencias:
- Introducción a la microscopía de fluorescencia. MicroscopíaU de Nikon https://www.microscopyu.com/techniques/fluorescence/introduction-to-fluorescence-microscopy. Consultado el 2021-04-11 17:20:40.

Suscríbase a nuestro boletín de noticias
Contenidos exclusivos de alta calidad sobre la eficacia visual
comunicación en la ciencia.