Een groot deel van de routine van een wetenschapper bestaat uit het ontwerpen en uitvoeren van experimenten.
De combinatie van laboratoriumtechnieken zal de meeste vragen van wetenschappers beantwoorden, en de werkstroom om nieuwe methoden voor te stellen hangt af van de achtergrond en ervaring van de wetenschapper.
Voor biologen kunnen celafbeeldingen veel zeggen over wat er aan de hand is met de processen en mechanismen die ze bestuderen.
Lichtmicroscopie is een zeer wijdverspreide techniek in de biologische wetenschappen.
Door het gebruik van kleurstoffen, antilichamen en fluorescerende sondes kunnen wetenschappers in de microscoopcellen beelden zien van wat anders te klein was om te zien en zelfs te bevatten.
Fluorescentiemicroscopen en het gebruik van fluorochromen werd mogelijk in 19301en tegenwoordig zijn er veel combinaties van fluorochromen mogelijk om eiwitten, organellen en structuren in cellen en weefsels te kleuren.
Fluorochromen (of fluoroforen) zijn moleculen die, wanneer ze worden aangeslagen met een specifieke golflengte van licht, licht uitzenden met een bepaalde golflengte dat wordt opgevangen door de lenzen van een microscoop en wordt omgezet in een echt beeld.
De combinatie van fluorescentie, lenzen en camera's stelt ons in staat om een beeld te maken van processen in cellen in veel verschillende aanzichten en aspecten.
Met de microscoop hebben we bijvoorbeeld een breder beeld van een plakje hersenen van een muis met een 2,5x of 4x objectief, en kleine details van het onderzochte actine cytoskelet in hetzelfde monster met een 63x objectief.
Om deze assays mogelijk te maken, kunnen we antilichamen of kleurstoffen tegen specifieke eiwitten in de cel of het weefsel gebruiken.
De verschuiving van Stokes verklaart dit fenomeen: fluoroforen verliezen trillingsenergie in de vorm van uitgezonden licht wanneer ze van een aangeslagen toestand teruggaan naar de grondtoestand. Fluorescentiemicroscopen leveren het licht om de fluorofoor te exciteren en ontvangen het uitgezonden licht. Het uitgezonden licht kan worden opgevangen door een lens, verwerkt in een CCD-camera en omgezet in een digitaal beeld.
Maar laten we het later hebben over het verwerven van celbeelden. Nu moeten we je laten kennismaken met voorbeelden en tips voor de belangrijkste stappen voor het verwerven van je beeld.
Hoe kiezen en combineren we verschillende soorten kleurstoffen en antilichamen om relaties tussen organellen en eiwitten in cellen of weefsels te zien en te begrijpen?
Eerst moeten wetenschappers op basis van hun onderzoek bepalen welke antilichamen en kleurstoffen ze gaan gebruiken.
Bijvoorbeeld, in dit artikelMendonça probeerde de effecten en mogelijke risico's van kationische nanopartikels met vaste lipiden (cSLN's) bij ratten te evalueren. Elk jaar worden er veel nanodeeltjes ontwikkeld en bestudeerd om de toediening van medicijnen of genen voor de behandeling van vele ziekten te verbeteren. Een van de interessante vragen in dit onderzoek was of de nanodeeltjes in staat waren om de hersenen te bereiken door de bloed-hersenbarrière te passeren. Deze barrière beschermt onze hersenen tegen circulerende gifstoffen of ziekteverwekkers en meestal is het niet wenselijk dat moleculen de barrière passeren. Maar in dit specifieke geval, Mendonça's Het doel was dat de nanodeeltjes de barrière zouden passeren en de hersenen zouden bereiken, om medicijnen of genen af te leveren in een toekomstige toepassing.
Om te zien of de nanodeeltjes aanwezig waren in het hersenparenchym, gebruikten de auteurs een endotheelcelmarker voor de vaten genaamd RECA-1 (weergegeven in rood), terwijl de celkernen werden gekleurd met een kleurstof genaamd DAPI (4′,6-diamidino-2-fenylindool), die blauw is. We kunnen ook kleine groene puntjes zien voor de nanodeeltjes buiten de vaten, wat betekent dat ze het hersenparenchym bereikten.
Bekijk de onderstaande infographic met een representatieafbeelding.
Laten we begrijpen wat het antilichaam voor RECA-1 (rood) doet.
Deze antilichamen zijn ontworpen om te dienen als specifieke probes en ze richten zich op een specifiek antigeen (in ons geval het eiwit RECA-1).
Ze kunnen gelabeld worden met een fluorofoor of later herkend worden door een secundair antilichaam gekoppeld aan een fluorofoor.
Daarom wordt het monster na opwarming met een lichtbron, het specifieke eiwit dat je zoekt wordt herkend in je monster door de emissie van licht met een specifieke golflengte.
In het geval van DAPI is deze kleurstof een tegenkleurstof voor kernen en nucleosomen en het zendt blauwe fluorescentie uit wanneer het zich bindt aan AT-regio's van het DNA.
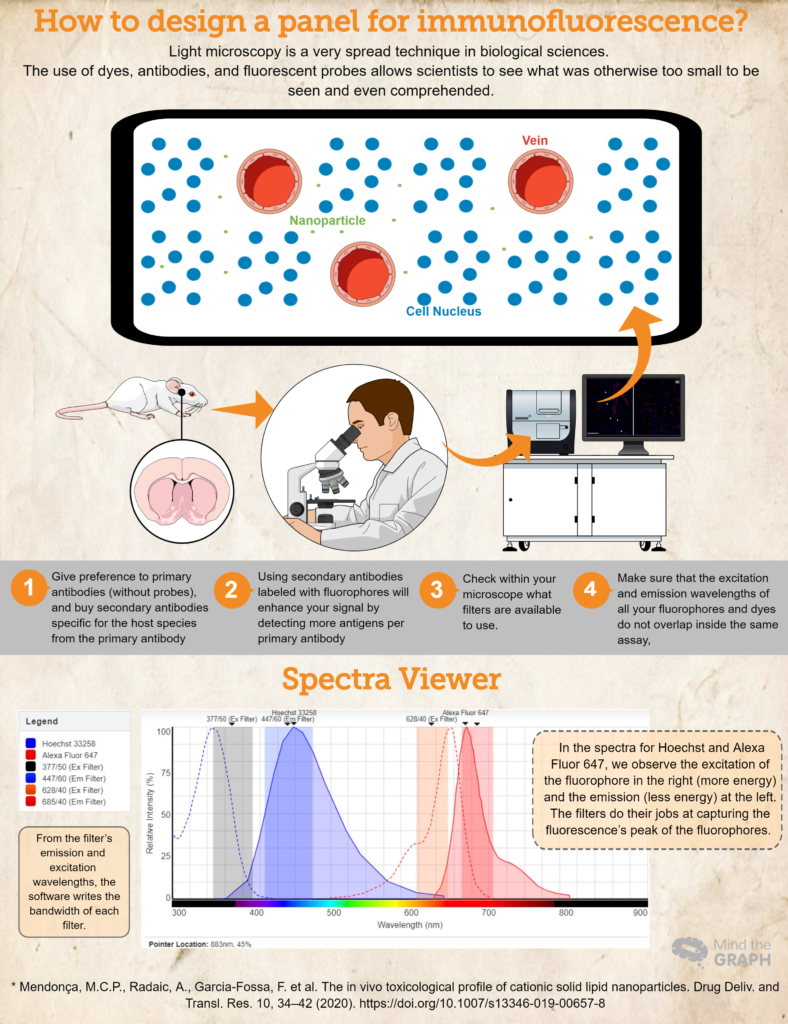
Hoe ontwerp je een panel voor immunofluorescentie?
Begin met deze stappen:
- Koop (of leen! Wetenschap moet zeer collaboratief zijn!) antilichamen en kleurstoffen die essentieel zijn voor je onderzoek. Geef de voorkeur aan primaire antilichamen (zonder probes) en koop secundaire antilichamen die specifiek zijn voor de gastheersoort van het primaire antilichaam. Als je bijvoorbeeld een primair antilichaam gebruikt dat geproduceerd is in konijnen, gebruik dan een secundair antilichaam voor anti-konijn. Dit garandeert specificiteit.
- Het gebruik van secundaire antilichamen gelabeld met fluoroforen zal je signaal versterken door meer antigenen per primair antilichaam te detecteren. Dit is ook een dynamischere manier om verschillende assays uit te werken, omdat de onderzoeker de kleuren in het panel kan aanpassen op basis van haar behoeften.
- Een andere belangrijke stap is om in uw microscoop te controleren welke filters beschikbaar zijn om te gebruiken. Je moet ervoor zorgen dat de excitatie- en emissiegolflengte van je fluorofoor binnen de excitatie- en emissiefilters liggen, anders kun je het emissielicht van je probes niet opvangen. U kunt gebruik maken van Fluorescentiespectra bekijken om de compatibiliteit te controleren.
- Om ervoor te zorgen dat de excitatie- en emissiegolflengten van al uw fluoroforen en kleurstoffen elkaar niet overlappen binnen dezelfde assay, Fluorescentiespectra bekijken is een geweldige keuze. Ze dekken bijna alle beschikbare fluoroforen!
Bekijk tenslotte een voorbeeld voor een hypothetisch experiment waarbij we Hoechst 33258 hebben voor de nucleïnezuren en een primair antilichaam tegen RECA-1 gelabeld met een secundair antilichaam Alexa Fluor 647.
Idealiter gebruiken we een microscoop met een DAPI-blokje (excitatie 377/50 en emissie 447/60) en een CY5-blokje (excitatie 628/40 en emissie 685/40). Al deze informatie hebben we ingevoegd op Fluorescentiespectra bekijken en verkreeg de spectra voor beide kleurstoffen en de bandbreedtes voor beide kubussen (bekijk het spectrum in de infographic hierboven).
Dit hypothetische essay is een goed voorbeeld waarbij de spectra van de fluoroforen binnen de excitatie- en emissiefilters horen, waardoor de onderzoeker zijn monsters op de best mogelijke manier kan vastleggen.
Nu is het tijd om naar het lab te gaan en alles in praktijk te brengen!
Ik hoop dat deze tips je helpen bij je volgende laboratoriumexperiment. Veel succes!
Referenties:
- Inleiding tot fluorescentiemicroscopie. Nikon's MicroscopieU https://www.microscopyu.com/techniques/fluorescence/introduction-to-fluorescence-microscopy. Geraadpleegd 2021-04-11 17:20:40.

Abonneer u op onze nieuwsbrief
Exclusieve inhoud van hoge kwaliteit over effectieve visuele
communicatie in de wetenschap.