Uma grande parte da rotina do cientista é projetar e realizar experimentos.
A combinação de técnicas laboratoriais responderá à maioria das perguntas propostas pelos cientistas, e o fluxo de trabalho para sugerir novos métodos depende da formação e da experiência do cientista.
Para os biólogos, as imagens das células podem dizer muito sobre o que está acontecendo com os processos e mecanismos que estão estudando.
Microscopia de luz é uma técnica muito difundida nas ciências biológicas.
O uso de corantes, anticorpos e sondas fluorescentes permite que os cientistas vejam nas células do microscópio imagens do que, de outra forma, seria pequeno demais para ser visto e até mesmo compreendido.
Microscópios de fluorescência e o uso de fluorocromos tornou-se possível em 19301Atualmente, muitas combinações de fluorocromos são possíveis para corar proteínas, organelas e estruturas dentro de células e tecidos.
Fluorocromos (ou fluoróforos) são moléculas que, quando excitadas com um comprimento de onda específico de luz, emitem luz de um comprimento de onda definido que será capturada pelas lentes de um microscópio e transformada em uma imagem real.
A combinação de fluorescência, lentes e câmeras nos permite obter uma imagem dos processos dentro das células em muitos aspectos e visualizações diferentes.
Por exemplo, usando o microscópio, temos uma visão mais ampla de uma fatia do cérebro de um camundongo em uma objetiva de 2,5x ou 4x, e pequenos detalhes do citoesqueleto de actina sondado na mesma amostra usando uma objetiva de 63x.
Para permitir esses ensaios, podemos usar anticorpos ou corantes contra proteínas específicas presentes na célula ou no tecido, e o anticorpo geralmente vem com um fluoróforo.
O deslocamento de Stokes explica esse fenômeno: os fluoróforos perdem energia vibracional na forma de luz emitida quando mudam de um estado excitado para o estado fundamental. Os microscópios de fluorescência fornecerão a luz para excitar o fluoróforo e receberão a luz emitida. A luz emitida pode ser capturada por uma lente, processada dentro de uma câmera CCD e transformada em uma imagem digital.
Mas falaremos sobre a aquisição de imagens de células mais tarde. Agora, devemos apresentar a você exemplos e dicas para as principais etapas antes de adquirir sua imagem.
Como escolhemos e combinamos diferentes tipos de corantes e anticorpos para ver e entender as relações entre organelas e proteínas dentro das células ou dos tecidos?
Primeiro, os cientistas precisam determinar quais anticorpos e corantes usar com base em suas pesquisas.
Por exemplo, neste artigoEm sua pesquisa, Mendonça estava tentando avaliar os efeitos e os possíveis riscos das nanopartículas lipídicas sólidas catiônicas (cSLNs) em ratos. Muitas nanopartículas são desenvolvidas e estudadas todos os anos, com o objetivo de melhorar a liberação de medicamentos ou genes para o tratamento de muitas doenças. Uma das questões interessantes desse estudo foi se as nanopartículas conseguiam chegar ao cérebro atravessando a barreira hematoencefálica. Essa barreira protege nosso cérebro de toxinas ou patógenos circulantes e, normalmente, não é desejável que as moléculas atravessem a barreira. Mas nesse caso específico, Mendonça's O objetivo era que as nanopartículas atravessassem a barreira e chegassem ao cérebro, para administrar medicamentos ou genes em uma aplicação futura.
Para verificar se as nanopartículas estavam presentes no parênquima cerebral, os autores usaram um marcador de células endoteliais para os vasos chamado RECA-1 (representado em vermelho), enquanto os núcleos das células foram corados com um corante chamado DAPI (4′,6-diamidino-2-phenylindole), que é azul. Também podemos observar pequenos pontos verdes para as nanopartículas fora dos vasos, o que significa que elas atingiram o parênquima cerebral.
Confira o infográfico abaixo com uma imagem de representação.
Vamos entender o que o anticorpo para RECA-1 (vermelho) está fazendo.
Esses anticorpos são projetados para servir como sondas específicas e têm como alvo um antígeno específico (no nosso caso, a proteína RECA-1).
Eles podem ser marcados com um fluoróforo ou reconhecidos posteriormente por um anticorpo secundário ligado a um fluoróforo.
Portanto, depois de excitar a amostra com uma fonte de luz, a proteína específica que você está procurando será reconhecida em sua amostra pela emissão de luz em um comprimento de onda específico.
No caso do DAPI, esse corante é um contracoloração de núcleos e nucleossomos e emite fluorescência azul quando se liga a regiões AT do DNA.
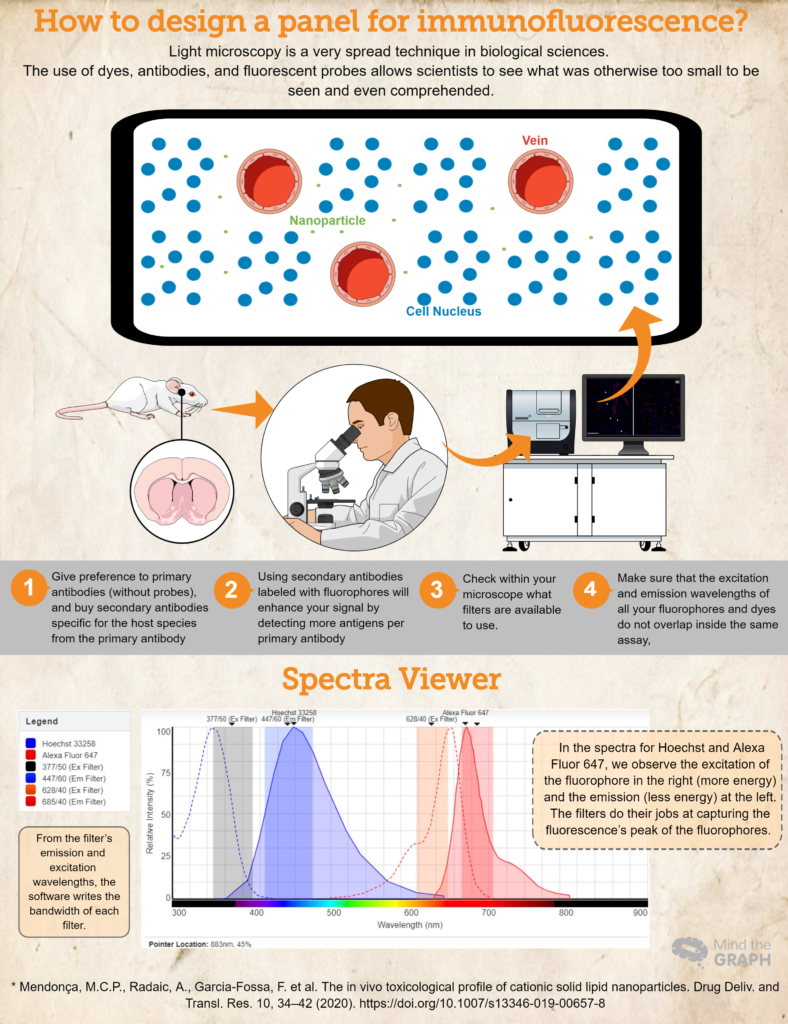
Como projetar um painel para imunofluorescência?
Comece com estas etapas:
- Compre (ou pegue emprestado! A ciência deve ser muito colaborativa!) anticorpos e corantes essenciais para sua pesquisa. Dê preferência a anticorpos primários (sem sondas) e compre anticorpos secundários específicos para a espécie hospedeira do anticorpo primário. Por exemplo, se estiver usando um anticorpo primário produzido em coelhos, use um anticorpo secundário para anti-coelho. Isso garantirá a especificidade.
- O uso de anticorpos secundários marcados com fluoróforos aumentará o sinal ao detectar mais antígenos por anticorpo primário. Além disso, essa é uma maneira mais dinâmica de elaborar diferentes ensaios, pois permite que o pesquisador modifique as cores do painel de acordo com suas necessidades.
- Outra etapa importante é verificar em seu microscópio quais filtros estão disponíveis para uso. Certifique-se de que os comprimentos de onda de excitação e emissão do fluoróforo estejam dentro dos filtros de excitação e emissão; caso contrário, não será possível capturar a luz de emissão das sondas. Você pode usar Visualizador de espectros de fluorescência para verificar a compatibilidade.
- Para garantir que os comprimentos de onda de excitação e emissão de todos os seus fluoróforos e corantes não se sobreponham no mesmo ensaio, Visualizador de espectros de fluorescência é uma ótima opção. Eles cobrem quase todos os fluoróforos disponíveis!
Por fim, verifique um exemplo de um experimento hipotético em que temos Hoechst 33258 para os ácidos nucleicos e um anticorpo primário contra RECA-1 marcado com um anticorpo secundário Alexa Fluor 647.
Idealmente, usaríamos um microscópio disponível com um cubo DAPI (excitação 377/50 e emissão 447/60) e um cubo CY5 (excitação 628/40 e emissão 685/40). Todas essas informações foram inseridas em Visualizador de espectros de fluorescência e obtivemos os espectros de ambos os corantes e as larguras de banda de ambos os cubos (confira o espectro no infográfico acima).
Esse ensaio hipotético é um bom exemplo em que os espectros dos fluoróforos pertencem aos filtros de excitação e emissão, possibilitando que o pesquisador capture suas amostras da melhor maneira possível.
Agora, é hora de ir para o laboratório e colocar tudo em prática!
Espero que essas dicas o ajudem em seu próximo experimento de laboratório. Boa sorte!
Referências:
- Introdução à Microscopia de Fluorescência. MicroscopiaU da Nikon https://www.microscopyu.com/techniques/fluorescence/introduction-to-fluorescence-microscopy. Acessado em 2021-04-11 17:20:40.

Assine nossa newsletter
Conteúdo exclusivo de alta qualidade sobre visual eficaz
comunicação na ciência.